KILLFILM
Controle van biofilmvorming in de productieomgeving om een langere shelf life te kunnen garanderen
Waarom dit project?
Wanneer een groep van micro-organismen samenkoekt op een oppervlak is er sprake van een biofilm. De micro-organismen zijn daarbij gewoonlijk ingebed in een matrix van polymeren (suikers, eiwitten of uronzuren) die ze zelf produceren (extracellular polymeric substance of EPS), waardoor ze erg kleverig zijn en moeilijk te verwijderen van oppervlakken. In een productie-omgeving verhoogt de aanwezigheid van biofilms dan ook de kans op microbiële contaminatie van de levensmiddelen (zie figuur). Maar doordat ze zo hardnekkig zijn, en ook niet altijd visueel waarneembaar zijn, kan een biofilm ook voor een contaminatie zorgen na reiniging vanop een schijnbaar proper oppervlak.
De 5 stages van biofilmvorming grafisch weergegeven: Van initiële en irreversibele aanhechting (links) over maturatie (midden) en dispersie (uiterst rechts). Bron: D. Monroe. "Looking for Chinks in the Armor of Bacterial Biofilms". PLoS Biology 5 (11, e307).
Biofilmen zijn daarom in veel voedingsbedrijven aanwezig zijn zonder dat het bedrijf zich hiervan bewust is. Ze worden voornamelijk aangetroffen in slicingmachines, dicingmachines, verpakkingsmachines, doseer- en afvulapparatuur, pompen, mengapparatuur, transportbanden, containers, dichtingen en snijtafels, en dit zowel op roestvrij staaloppervlakten als elastomeren (rubbers) en plastics.
Afhankelijk van het voedingsproduct, de omgeving, de reinigingsprotocollen, de materialen, … kan de samenstelling verschillen. Ook zijn bepaalde micro-organismen, zoals Pseudomonas-soorten meer geneigd om biofilms te vormen dan andere.
Innovatie in verband met het opsporen en verwijderen van biofilmen is noodzakelijk gezien de huidige technieken en procedures vaak ontoereikend zijn. Het efficiënt verwijderen van biofilmen zal een verbetering van de houdbaarheid met zich meebrengen en de frequentie van incidentele besmettingen met pathogenen verlagen. Dit vergt echter voldoende inzicht in de microbiële en chemische samenstelling van de biofilmen die typisch voorkomen in de verschillende voedingssectoren.
Onderzoek en resultaten
KILLFILM was een collectief onderzoeksproject (type VIS-CO), waar biofilms onder de loep werden genomen genomen, evenals de effectiviteit van verschillende reinigingsproducten en -protocollen en preventieve maatregelen.
In eerste instantie werd dieper ingegaan op de samenstelling van de biofilms voor de identificatie en identificatie van de belangrijkste biofilmvormers, en karakterisatie van de EPS-matrix die ze vormen.
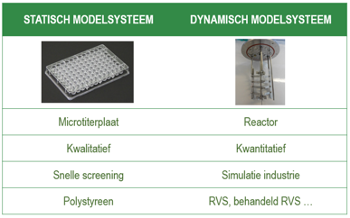
Een aantal terugkerende en dominante micro-organismen uit de biofilmen werden vervolgens opgekweekt en als modelorganismen gebruikt voor verder onderzoek. Met deze modelorganismen werden twee types modelsystemen ontwikkeld, zoals weergegeven in onderstaande figuur.
Met behulp van deze modelsystemen kon het proces van biofilmvorming verder bestudeerd worden, en konden een aantal preventieve maatregelen getest worden. Zowel commerciële (Realco, zie ook in dit filmpje) en niet-commerciële (uit literatuur) componenten, ‘biofilm-inhibitoren’, werden daarbij getest op hun effectiviteit en werking. Deze componenten blijken vooral preventief potentieel te hebben. Ze zijn bovendien niet stam-specifiek, waardoor ze kunnen ingezet worden in combinatie met de bestaande reinigings- en desinfectieprotocollen zodat de nieuwe vorming van biofilms kan voorkomen of vertraagd worden.
Tenslotte werden ook de verschillende manieren voor het effectief verwijderen van biofilms geëvalueerd. Een goede reiniging, alvorens over te gaan tot de desinfectie, is daarbij essentieel voor het verwijderen van een biofilm. De keuze van het desinfectans heeft wel een belangrijke invloed. Bij Cleaning in Place is een desinfectans op basis van een mengsel van perazijnzuur en waterstofperoxide efficiënter dan een desinfectiemiddel gebaseerd op waterstofperoxide voor de verwijdering van zowel Lactobacillus rhamnosus, als E. coli. Bij het Open Plant Cleaning protocol werd de hoogste biofilmreductie bekomen met chloorhoudende producten voor de reiniging en desinfectie. Echter, bij een heropkweek van 24 uur werd voor alle geteste reinigings- en desinfectieproducten een significante stijging in kiemgetal waargenomen. Een herhaalde reiniging en desinfectie is dus zeer belangrijk.
De bevindingen ter preventie en verwijdering van de biofilms werden in richtlijnen gegoten, die een leidraad kunnen zijn bij het opstellen van reiniging- en desinfectieprotocols die rekening houden met biofilms.
Projectpartners
Flanders’ FOOD beheert en coördineerde het project. De uitvoering was in handen van:
- KaHo Sint-Lieven Gent, Laboratorium voor Enzym, Fermentatie- en Brouwerijtechnologie – Prof. Alex Verplaetse
- UGent-IBM en UGent-LM – Prof. Katleen Raes – Prof. Peter Vandamme
- KU Leuven, Centre of Microbial and Plant Genetics - Prof Jos Vanderleyden en Dr. Hans Steenackers
- ILVO, Eenheid Technologie & Voeding-onderzoeksdomein Voedselveiligheid – Dr. ir. Koen De Reu en Prof. Marc Heyndrickx
Aanschaffen van de resultaten
Het project is afgelopen sinds 31/12/2016, maar het rapport met de resultaten en de adviezen kan wel nog besteld worden. Bij de bestelling van het rapport kan er ook een persoonlijke toelichting worden gegeven door één van de innovatiemanagers. De prijs hiervan is afhankelijk van de deelnameprijs voor een project, en is afhankelijk van de ouderdom van de resultaten en de grootte (aantal werknemers) van het bedrijf. Voor meer info en/of een bestelling, neemt u best contact op met de projectbeheerder.
Vervolgacties
Extra onderzoek is noodzakelijk om de werking van de preventieve ‘biofilm-inhibitoren’ in combinatie met de gebruikte reinigings- en desinfectiemiddelen en -protocollen na te gaan. Hoewel reeds kon bevestigd worden dat met behulp van de juiste enzymmengsels een biofilm sterk gereduceerd kon worden waarbij de hergroei beduidend afgeremd wordt. Mogelijk kan de toevoeging van de biofilm-inhibitoren ook voor een verzwakking van de aanwezige biofilms leiden waardoor deze efficiënter kunnen verwijderd worden.
Maar er zijn nog andere manieren om de vorming van biofilms te gaan voorkomen. Zo kan de keuze en de behandeling van de oppervlakken een grote invloed hebben op het aanhechtingspotentieel van de micro-organismen. In het project CLEANSURFACE werd daarom dieper ingegaan op het biofilmwerend vermogen van dergelijke gecoate oppervlakken.